Обнаружение только одного атома меди в активной мономерной единице фермента заставило говорить о принципиальном отличии фермента N.crassa от тирозиназы высших грибов, у которой было установлено присутствие двух атомов меди в активном центре.
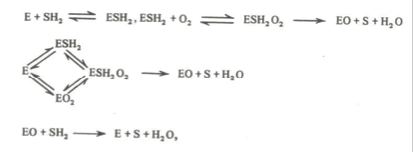
Такое представление как будто нашло подтверждение в более поздних исследованиях фермента другого штамма N.crassa (No1757). Активный препарат был получен тем же путем, что и предыдущий, но с некоторыми модификациями методики: «сырой» экстракт —> осаждение (NH4)2SO4 —> ацетоновое фракционирование —> повторное осаждение (NH4)2SO4 —> хроматография на целите и окисиапатите. При этой очистке удельная активность препарата возрастала с 10 до 650 ед/ мг белка. Минимальная молекулярная масса таким образом очищенной тирозиназы была определена в 31000±2000 единиц. Размер функционирующих молекул составлял 33000±2000 единиц. Общее содержание меди было 0,21% (±0,01). Кинетические данные в сочетании с изучением специфики связывания субстратов показали присутствие на молекуле фермента только одного участка для связывания о-дифенолов и подтвердили наличие одного атома меди в его активном центре. Причем (судя по данным ЭПР) почти вся медь находилась в форме Cu(I), поскольку только 4% количества элемента давали сигнал, соответствующей Cu(II), В спектре поглощения очищенного препарата фермента пик поглощения при 345 нм свидетельствовал о присутствии оксиформы тирозиназы. Некоторые приблизительные расчеты показали, что в свежевыделенном ферменте она может содержаться в количестве 33%. На основании изучения каталитического механизма катехолазной реакции фермента N. crassa (окисления о-дифенолов, действия ингибиторов и др.) была предложена следующая схема его действия:
где Е, EO, SH2 и S обозначают соответственно свободный фермент, интермедиат (подобный комплексу фермент-ион меди), субстрат-дифенол и о-хинон.