Ферменты в течение длительного времени считались самой чувствительной к нагреванию группой клеточных компонентов. Поэтому биохимики в своих поисках молекулярных основ психрофилии, которую они отождествляли главным образом с неспособностью организма расти при повышенных температурах, прежде всего обратились к исследованию теплоустойчивости каталитической активности психрофильных ферментов (Rose, 1963).
Основное внимание при этом стали уделять ферментам, связанным с энергетическим обменом. Многие авторы, выбирая эти объекты для своих исследований, опирались на положение, высказанное Эдвардсом и Риттгер (Edwards, Rettger, 1937), что максимальная термотолерантность бактерий определяется минимальной температурой, при которой разрушаются ее дыхательные ферменты. В своих экспериментах указанные авторы действительно находили хорошее соответствие между максимальными температурами роста некоторых штаммов Bacillus и температурой, при которой инактивировались некоторые ферменты дыхательной системы клеток.
Уже давно стала очевидной узость этого положения, но тем не менее и среди психрофилов найдены формы, для которых оно справедливо. Одними из первых таких организмов были факультативный пеихрофил V. marinus PS-207, дегидрогеназа яблочной кислоты которого быстро инактивировалась при 30° (Burton, Morita, 1963), и облигатный психрофил V. marinus МР-1 (Langridge, 1965; Morita, 1966; Langridge, Morita, 1966; Robison, Morita, 1966). Дегидрогеназа этого пенхрофила, будучи стабильной in vivo при температуре от 0 до 15°, начинала быстро инактивироваться сразу после 15°— оптимальной для активности фермента и роста организма температуры.
Описанное выше явление наряду с параллелизмом в кинетике роста и степени ферментной активности способствовало утверждению мнения, что именно значительная термолабильность этого фермента является одной из причин психрофилии данного штамма. В бесклеточных экстрактах при 30° за 11 мин. терялось до 95% исходной активности. Та же дегидрогеназа яблочной кислоты в бесклеточных экстрактах термофила Bacillus stearotermophilus инактивировалась только при 78° (Morita, Haight, 1962, цит. по Langridge, Morita, 1966). Глюкозо-6-фосфатдегндрогеназа того же организма не столь чувствительна к нагреванию. Частично очищенная, она стабильна между 5 и 26°, однако за 1 час экспозиции при 36° теряет 90% активности (Howard, Miller, Becker, цит. по Morita, 1975). Активность альдолазы V. marinus выше 32°, известными методами вообще не фиксируется (Jones, 1973, цит. по Morita, 1975).
Рис. 26. Действие 30-минутиой инкубации при повышенных температурах на активность частично очищенной малатдегидрогеназы Vibrio marinus MP-I (Langridge, Morita, 1966)
На оси ординат — остаточная активность, %
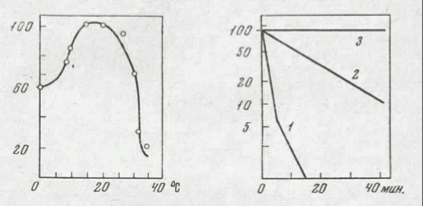
Рис. 27. Действие температуры на триозофосфатизомеразную активность бес- клеточных экстрактов (Shing et аl., 19721
Clostridium sp. 69: 1 — при 35°, 2 — при 32°; Clostridium pasteurianum: 3 — при 40°. На оси ординат — активность, % от начальной