Этот вопрос стал одним из направлений, по которому шел поиск механизмов, обеспечивающих значительную скорость реакций и рост психрофилов при низких и очень низких температурах. Теоретически преимущество ферментов с низкой энергией активации (р) в условиях низких температур очевидно и становится все более явным по мере усиления охлаждения биологических систем, вызывающего замедление химических реакций: низкая температура активации позволяет снизить температурную зависимость процесса (Langridgc, 1963). Поэтому не случайно, что интерес к этому свойству ферментов психрофильных организмов возник давно, несмотря на то что первоначально были получены отрицательные результаты.
Ингрэхэм и Бейля (Ingraham, Bailey, 1959) определили энергию активации трех пар ферментов окислительного расщепления глюкозы (малатдегидрогеназы, изцоцитратдегидрогеназы и глюкозо-6-фосфатдегидрогеназы) в экстрактах психрофильного Pseudomonas sp. и мезофильного Ps. aeruginosa и установили, что они очень близки по величине. Когда же Бертон и Морита (Barton, Morita, 1963) исследовали дегидрогеназу яблочной кислоты сначала у факультативно психрофильного штамма V. irtarinus PS- 207, а затем у облигатного психрофила V. marinus МР-1, то они четко продемонстрировали различие в энергиях активации для соответствующих ферментов психрофилов и мезофилов: первые имели приблизительно вдвое меньшую величину μ, чем фермент Е. coli.
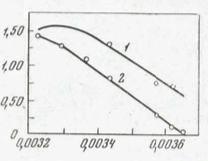
Рис. 25. Кривая Аррениуса действия температуры на удельную активность сериндегидратазы Ps. aeruginosa (1) и Е. coli (2) (Stanley, Boyd, 1967)
На оси абсцисс—1/Т, на оси ординиат — log10 удельной скорости роста